Estructura de la materia.
Moléculas

Una molecula es una particula elemntal que esta formada por un numero entero de atomos.
Los átomos que componen una molécula pueden ser iguales y también diferentes.
Átomos:
Un átomo es la partícula elemental que constituye las moléculas.
Todos los átomos se caracterizan por poseer un núcleo y una zona extranuclear.
Los átomos están constituidos por tres tipos de partículas fundamentales: protones, neutrones y electrones.
Los protones y los neutrones se encuentran en el nucleo del atomo. Los electrones forman una nube alrededor del núcleo llamada zona extranuclear. Todos los electrones que constituyen los distintos tipos de átomos son idénticos. De la misma manera, todos los protones y los neutrones son idénticos.
Un átomo es esencialmente espacio vacío. Casi toda su masa esta concentrada en el nucleo.
- Si pudiéramos llenar una esfera de 1cm de diámetro de núcleos atómicos desnudos de hidrógeno, la esfera pesaría 133000000 toneladas.
Los protones y los electrones poseen carga de igual valor pero distinto signo (Positivo y negativo respectivamente). Los neutrones no tienen carga.
Todo atomo es electricamente neutro. Por lo tanto el numero de protones y electrones que posee un átomo debe ser igual para que la carga total sea nula.
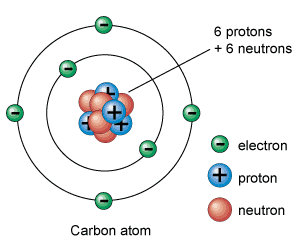
Existen diferentes tipos de átomos en la naturaleza, cada uno de ellos difieren entre si por el numero de protones y neutrones que contienen.
Elemento químico es el nombre que recibe el conjunto de átomos con el mismo numero de protones.
Cada elemento se caracteriza por un numero entero llamado numero atómico (Z) y es el numero de protones.
Decimos que el numero atómico (Z) es la identidad del elemento.
Numero de masa y numero de neutrones.
El numero de masa o numero másico indica la cantidad de neutrones mas protones que posee un atomo. Este numero se simboliza con la letra A.
Numero de neutrones = A - Z
Cuando dos átomos poseen el mismo numero de masa y el mismo numero atomico decimos que pertenecen al mismo nucleido.
Isotopos:
El numero de neutrones para un elemento dado puede variar.
Entonces, se llaman isotopos a los atomos que tienen igual numero de protones y distinto numero de neutrones.
Unidad de masa atómica y masa atómica relativa.
La unidad de masa atómica (u.m.a.), la cual se define como 1/12 de la masa de un atomo de carbono 12.
La masa de un átomo de Carbono  , por lo tanto una unidad de masa atómica equivale a:
, por lo tanto una unidad de masa atómica equivale a:
Se define como masa atómica relativa de un elemento X a la razón entre la masa promedio de un átomo de dicho elemento X y una unidad de masa atómica, u.m.a.
La masa atómica relativa de un elemento es el promedio en peso de las masas de los isotopos que lo constituyen. La masa atómica relativa NO es la suma de los protones y neutrones de un elemento. La mayoría de las masas atómicas relativas son números fraccionarios y no enteros.
Masa molecular relativa:
Para las sustancias constituidas por moléculas definimos, en forma análoga el concepto de masa molecular relativa.
Se llama masa molecular relativa de una sustancia a la razón entre la masa promedio de una molécula de dicha sustancia y una unidad de masa atómica.
--> Para calcular la masa molecular relativa de una molecula se deben sumar las masas atomicas relativas de los elementos que la integran.
Mr (SO2) = Ar (S) + 2 Ar(O) = 32,02 + 2x15,99 = 64
Zona extranuclear: Orbitales atómicos.
Esta zona tiene aspecto de nube ya que, como no existe la posibilidad de conocer simultáneamente la posición y velocidad de un electrón en un instante dado en un átomo, solo podemos referirnos a la probabilidad de hallarlo en un determinado lugar alrededor del nucleo de dicho átomo.

Se llama orbital atómico a la zona del espacio alrededor del núcleo donde existe elevada probabilidad de encontrar a un electrón.
Los orbitales que presentan simetría esférica se denominan n orbitales s.
La probabilidad de hallar a los electrones en determinadas zonas del espacio alrededor del núcleo atómico esta relacionada con los distintos estados de energía posibles para los electrones. Para poder describir la energía asociada a cada electrón se introducen los números cuánticos.
- n: numero cuántico principal: esta vinculado con el diámetro de la nube electrónica. Este numero determina el nivel de energia y la capa electrónica a la cual pertenece el electrón.
- l: numero cuántico secundario: esta relacionado con la forma de la nube electrónica. Este numero indica el subnivel o subcapa a la cual pertenece el electrón. Los distintos subniveles se denominan con las letras s, p, d, f, g.

- m: numero cuántico magnético: esta relacionado con la orientación de la nube electrónica. Este numero determina el orbital al cual pertenece el electron.

- s: numero cuántico del spin. Todo sucede como si el electrón girase sobre si mismo como un trompo. Por lo tanto solo hay dos sentidos de giro posibles. 1/2 o -1/2.
Estructuras electrónicas por niveles.
A medida que aumenta el numero de electrones de un átomo, estos se van acomodando en distintas capas o niveles de energía.
Representar la estructura electrónica por niveles consiste en describir la distribución de los electrones que contiene un átomo respecto de los distintos niveles de energía en los que se encuentran los orbitales.
Configuración electrónica.
Cada conjunto de numeros cuanticos esta sujeto a una restriccion expresada por el Principio de exclusión de Pauli : en un átomo no existen dos electrones cuyos conjuntos de números cuánticos sean iguales. Por esta razón, puede haber 2 electrones como máximo en cada orbital.
El principio de energía mínima dice que los electrones ocupan los niveles y subniveles disponibles de menor energía del átomo no excitado, que corresponden, en general, a los valores mas bajos posibles de n y l.

La tabla periódica.
La ley periódica actual establece que:
- Las propiedades de los elementos químicos no son arbitrarias sino que dependen de la estructura del atomo y varían de manera sistemática con el numero atómico.
Los elementos quedan dispuestos en la tabla, formando hileras horizontales, llamadas periodos y columnas verticales llamadas grupos.

Grupos y periodos:
Periodo:
Los elementos que se encuentran en una misma fila horizontal se dice que pertenecen a un mismo periodo de la tabla.
El numero del periodo al cual pertenece un elemento en la clasificación periódica coincide con el numero de niveles en que se ubican los electrones en sus átomos.
Cada periodo esta asociado con un determinado nivel maximo de energia.
Existen 7 periodos en total.
Grupo:
En la tabla periódica actual existen 18 grupos o columnas verticales, en cada uno de los cuales están ubicados elementos de propiedades similares.
La forma en que se combinan los elementos y sus propiedades químicas están íntimamente vinculadas con el numero de electrones que tienen sus átomos en el ultimo nivel.
Los elementos neon, argon, kripton, xenon y radon pertenecientes al grupo 18 de la tabla periodica tienen 8 electrones en su ultimo nivel. Esa estructura es particularmente estable, por lo que no tienden ni a ganar ni a perder electrones.
Clasificación de los elementos.

Los gases nobles o gases monoatómicos, también llamados gases inertes, tienen una estructura electrónica estable.
No tienden a ganar electrones ni los pierden con facilidad.
Los no metales tienden a captar electrones al combinarse con otros elementos.
Los metales, que también pueden llamarse elementos electropositivos. Se caracterizan porque al constituir las diversas sustancias sus átomos habitualmente pierden electrones.
Espero que les haya servido! / les haya interesado. Muchas gracias!
Si tenes ganas de recibir mas contenido de calidad, entonces hazte patreon! Tu ayuda me motiva. Si no podes permitírtelo, con hacer un click en alguna publicidad me ayudas muchísimo!
No hay comentarios:
Publicar un comentario