Formación de Compuestos. El mejor mapa conceptual que vas a encontrar.
Ahora voy a explicar cada uno por separado.
Oxidos basicos y acidos.
Se llama oxido a todo compuesto binario oxigenado. Un oxido es un compuesto constituido por dos elementos, uno de los cuales es siempre oxigeno.
Oxido básico
Los óxidos básicos son óxidos de metales. La unión entre el oxigeno y el metal se produce a través de una unión iónica. Por lo tanto los óxidos básicos poseen estructura iónica.
- Una reacción química es un proceso en el cual una sustancia cambia para formar una o mas sustancias nuevas. Se representan mediante ecuaciones químicas. Por ejemplo el gas hidrógeno (H2) puede reaccionar con el gas oxigeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
H2 + 1/2 O2 --> H2O
El "+" se lee "reacciona con" y la flecha significa "produce". Las formulas químicas a la izquierda se llaman reactivos y las formulas químicas a la derecha se llaman productos de la reacción. Los números al lado de las formulas son los coeficientes estequiométricos.
¿Que reaccion ocurre cuando se forma un oxido básico?
El oxígeno que, libre y en condiciones normales, es un gas formado por moléculas diatómicas, reacciona con el metal que es monoatómico y forma oxido correspondiente.
O2 + metal --> Oxido Basico
>Para escribir la formula de un oxido metálico, observa que siempre debes colocar el metal delante del oxigeno. Seguidamente colocas como subíndice los estados o números de oxidación de cada uno pero intercambiados y por ultimo simplificas si son múltiplos.
Ejemplo: O2 reacciona con Calcio.
n° de oxidacion del oxigeno: -2
n° de oxidación del calcio: +2
O2 (2-) + Ca(2+) --> Ca2O2 = CaO (Se simplifican por ser múltiplos).
También existen óxidos de metales que no siempre pierden el mismo numero de electrones cuando se combinan con oxigeno. Por ejemplo, existen compuestos del hierro en los cuales un átomo de hierro pierde dos electrones para dar el catión Fe (2+) (los números de oxidación se indican colocando el signo del anión atras del numero) Y otros compuestos donde el átomo de hierro pierde tres electrones y se forma el catión Fe (3+)
O2 + Fe (2+) --> FeO
O2 + Fe (3+) --> Fe2O3 (no se pueden simplificar)
¿Como se nombra?
Nomenclatura moderna:
Los óxidos básicos deben nombrarse teniendo en cuenta los numerales de Stock que implica considerar dos posibilidades:
a) Si el metal posee un solo numero de oxidacion anteponemos la palabra oxido al nombre del metal.
Por ejemplo: CaO es oxido de calcio.
b) Si el metal posee mas de un numero de oxidación, al costado del nombre del metal entre paréntesis y con números romanos se agrega el numero de oxidacion con el que esta actuando el metal.
FeO es Oxido de hierro (II).
Fe2O3 es Oxido de hierro (III).
Nomenclatura clásica:
Asigna las siguiente terminaciones:
oso cuando el átomo pierde el menor numero de electrones (menor numero de oxidacion)
ico cuando el átomo pierde el mayor numero de electrones (mayor numero de oxidacion).
Por proporciones:
Si bien no es la mas utilizada, es indicando las proporciones de ambos elementos mediante el sistema de prefijos. Estos indican cuantos átomos de metal y cuantos atomos de oxigeno forman el oxido.
Por ejemplo:
Cu2O: Monóxido de dicobre.
Au2O3: Trióxido de dioro.
Oxidos acidos
Los óxidos ácidos (antes llamados anhídridos), son óxidos de no metales. La unión entre el oxigeno y un no metal se produce a través de una unión covalente. Por lo tanto los óxidos ácidos existen como moléculas.
¿Que reaccion ocurre?
O2 + No metal --> Oxido Ácido.
¿Como se escribe la formula?
Cuando escribas la formula de un oxido no metalico, observa que siempre debes colocar el no metal delante del oxigeno. Seguidamente colocas como subíndice los estados o números de oxidación de cada uno pero intercambiados y por ultimo simplificas si son múltiplos.
¿Como se los nombra?
Según la nomenclatura moderna se los denomina teniendo en cuenta la proporción de ambos elementos mediante el sistema de prefijos.
Ejemplos:
N2O3 TRIóxido de DInitrógeno
N2O5 PENtóxido de DInitrógeno
SO2 DIóxido de azufre
También, existen oxidos acidos de no metales que poseen mas de dos números de oxidación, por ejemplo, los números de oxidación positivos del cloro.
Son cuatro: +1, +3, +5, +7
Cl(1+) + O2 --> Cl2O Monóxido de dicloro
Cl(3+) + O2 --> Cl2O3 Trióxido de dicloro
Cl(5+) + O2 --> Cl2O5 Pentaóxido de dicloro
Cl(7+) + O2 --> Cl2O7 Heptóxido de dicloro
(ecuaciones no balanceadas)
La nomenclatura clásica, frecuentemente usada todavía, asigna las siguientes terminaciones:
oso cuando el no metal actúa con el menor numero de oxidacion.
ico cuando el no metal actúa con el mayor numero de oxidacion.
En el caso que el no metal tenga más de dos números de oxidación, como es el caso del Cloro, cuando el no metal con el menor numero de oxidación se antepone el prefijo hipo y la terminación oso. Cuando el no metal actúa con el numero de oxidación mayor se antepone el prefijo per y la terminación ico.
Cl2O oxido HIPOclorOSO
Cl2O3 oxido clorOSO
Cl2O5 oxido clorICO
Cl2O7 oxido PERclorICO
Peróxidos
Los peróxidos son óxidos que se caracterizan por tener dos átomos de oxigeno unidos entre si mediante un enlace covalente.
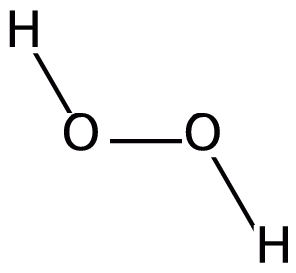
De acuerdo con este concepto, el peroxido de hidrogeno, sustancia corrientemente denominada agua oxigenada, posee las siguientes formulas:
Formula molecular: H2O2
Hidruros metálicos y no metálicos.
Hidruro metálico
De la combinación del hidrógeno con metales resultan compuestos sólidos que se denominan hidruros metálicos. Los hidruros formados con los metales del Grupo 1 y 2 (a excepción del Be y Mg) se conocen como hidruros salinos.
Hidrogeno + metal --> Hidruro metalico
¿Como se escribe la formula y como se los nombra?
Primero se escribe el símbolo del metal y luego el del hidrógeno. Después se intercambian los números de oxidación, teniendo en cuenta que los en los hidruros metálicos el hidrógeno actúa con -1. La fórmula del hidruro que forma el sodio seria: NaH
Para nombrarlos simplemente anteponemos la palabra hidruro al nombre del metal.
Hidruro no metálico
Son compuestos formados por la reacción de un no metal con el hidrógeno y a diferencia de los hidruros metálicos estos son gaseosos. Se conocen como hidruros covalentes. Otra característica es que el no metal siempre actúa con el menor numero de oxidación.
Hidrogeno + no metal --> hidruro no metalico
¿Como se los nombra?
Para nombrarlos se agrega el sufijo uro al nombre del no metal.
HI yoduro de hidrógeno
H2S Sulfuro de hidrógeno
EXCEPCIÓN: NH3. En este caso particular es el hidrógeno que se escribe con uro.
Sera entonces: hidruro de nitrogeno (amoniaco).
Compuestos Ácidos.
Tienen las siguientes propiedades:
- En soluciones acuosas predominan los iones H+ sobre los iones OH-
- Tienen sabor "Ácido". Ten presente que no deben probarse bajo ningún concepto, ninguna sustancia química, ya que puede ser corrosiva o venenosa.
- Enrojecen la tintura de tornasol. Este es un liquido obtenido a partir de ciertos líquenes. Presenta la propiedad de virar del color azul a rojo en presencia de ácidos.
- Reaccionan con ciertos metales desprendiendo hidrógeno.
- Reaccionan con carbonatos desprendiendo dióxido de carbono (CO2)
- Reaccionan con las bases neutralizando.
Oxoácidos
Son ácidos que contienen el elemento oxigeno.
Oxido ácido + agua --> Oxoácido
¿Como se escribe la formula?
- Se colocan todos los elementos que se reaccionan, agrupados y en un determinado orden. El orden es el siguiente: primero el hidrógeno y luego el resto de los elementos en el orden que corresponde a la secuencia real de los átomos. (Por lo general hidrogeno, no metal y oxigeno)
- Luego se coloca a cada uno, como subíndice, la cantidad total de átomos que reaccionan.
Ejemplo:
CO2 + H2O --> H2CO3
Observa que los tres átomos de oxigeno que forman parte de la molécula de H2CO3 provienen de los dos átomos de la molécula de CO2 mas un átomo de oxigeno de la molécula de H2O.
3_ En el caso de que los subíndices sean múltiplos se simplifican.
¿Como se nombran?
Los oxoácidos se nombran con la palabra ácido y en forma similar a lo hecho con los óxidos básicos, la nomenclatura corriente denomina con la terminación oso al compuesto menos oxigenado y con la terminacion ico al mas oxigenado.
Por ejemplo: H2SO3 es ácido sulfuroso y el H2SO4 es el ácido sulfúrico.
Como antes pasaba con los ácidos que presentan mas de 2 numeros de oxidacion, se incluyen las terminaciones hipo y per.
Siendo por ejemplo:
HClO4 :ácido perclórico
HClO ácido hipocloroso
CASO ESPECIAL (Sí, esta lleno de casos especiales)
En la mayoría de los casos el oxigeno reacciona con una molécula de agua para dar el oxoácido correspondiente, pero no es así para el caso del fósforo (entre otros). El oxido fosforoso y el oxido fosforico reaccionan con una, dos y tres moléculas de agua. A partir de cada oxido se podrán formar tres oxoácidos dependiendo del numero de moléculas de agua con que reaccione.
- Óxido ácido reacciona con una molécula de agua: se agrega el prefijo meta
- Óxido ácido reacciona con dos moléculas de agua: se agrega el prefijo piro
- Óxido ácido reacciona con tres moléculas de agua: se agrega el prefijo orto
Ejemplos:
P2O5 + H2O ---> 2 HPO3 Ácido Metafosfórico
P2O5 + 2 H2O --> H4P2O7 Ácido Pirofosforico
P2O5 + 3 H2O --> 2 H3PO4 Ácido Ortofosfórico
(Cuando solo figura el nombre del ácido fosforico sin ningun prefijo, se considera que se refiere al ortofosfórico)
Hidracidos
Se denominan hidrácidos a ciertos hidruros covalentes cuyas soluciones acuosas tienen carácter ácido.
-> Son hidruros, es decir, compuestos binarios constituidos por hidrógeno y otro elemento.
->tienen uniones covalentes, por consiguiente, son hidruros de no metales;
->en soluciones acuosas tienen carácter ácido, manifiestan las propiedades generales de los ácidos.
Hidrácidos mas importantes.
HF (en solución acuosa) --> Ácido fluorhídrico
HCl (en solución acuosa) --> Ácido clorhídrico
HBr (en solucion acuosa) --> acido bromhidrico
HI (en solución acuosa) --> Ácido yodhídrico
H2S (en solución acuosa) --> ácido sulfhídrico
Compuestos básicos o hidroxidos
Son sustancias que se caracterizan porque contienen iones hidróxido.

El ion hidróxido (OH-) esta constituido por un atomo de hidrogeno y un átomo de oxigeno unidos por un enlace covalente. El átomo de oxigeno completa los 8 electrones del ultimo nivel con un electrón adicional señalado con (triangulo). Este electrón adicional, da la carga negativa al ion hidróxido.
Los hidróxidos son bases o tienen carácter básico. Sus propiedades químicas son, en cierta medida, opuestas a las de los ácidos.
- En soluciones acuosas preponderan los iones OH-.
- No reaccionan con metales desprendiendo H2.
- Con los carbonatos no reaccionan desprendiendo CO2.
- La tintura de tornasol vira al color azul.
- Dan reacciones de neutralizacion con los ácidos.
¿Que reaccion ocurre?
Los oxidos basicos por reaccion con el agua originan hidroxidos metalicos.
Ejemplo:
CaO + H2O --> Ca(OH)2
Cada ion calcio tiene dos cargas positivas Ca(2+). Por lo tanto, se requieren dos iones hidróxido (OH-) para neutralizar su carga.
¿Como se escribe la formula y como se nombran?
Las formulas de los hidróxidos contienen el símbolo del metal y tantos grupos OH- como indica la carga del ion metálico.
Se los denomina igual que el oxido del cual proviene, cambiando la palabra oxido por hidroxido.
Ejemplos:
Fe(OH)2 hidróxido ferroso o hidróxido de hierro (II)
Fe(OH)3 hidróxido férrico o hidróxido de hierro (III)
Na(OH) hidróxido de sodio.
Espero que les haya servido! / les haya interesado. Muchas gracias!
Si tenes ganas de recibir mas contenido de calidad, entonces hazte patreon! Tu ayuda me motiva. Si no podes permitírtelo, con hacer un click en alguna publicidad me ayudas muchísimo!
www.patreon.com/Apuntesing
Espero que les haya servido! / les haya interesado. Muchas gracias!
Si tenes ganas de recibir mas contenido de calidad, entonces hazte patreon! Tu ayuda me motiva. Si no podes permitírtelo, con hacer un click en alguna publicidad me ayudas muchísimo!
www.patreon.com/Apuntesing

No hay comentarios:
Publicar un comentario